Antyoksydanty 01
Opublikowane według a.L w uroda · 2 Październik 2018
Tags: Antyoksydanty, przeciwutleniacze, Medycyna, Estetyczna
Tags: Antyoksydanty, przeciwutleniacze, Medycyna, Estetyczna
Antyoksydanty, przeciwutleniacze. Część 1.
Co to są antyoksydany? Hamowanie procesu starzenia, spowalniacze starzenia.
Antyoksydanty czyli przeciwutleniacze to związki spowalniające procesy starzenia, chroniące przed nowotworami, usuwające z organizmu wolne rodniki. Do przeciwutleniaczy zaliczamy witaminy: C, E, A, karotenoidy, biflawonoidy, cynk, selen, koenzym Q.
Działanie przeciwutleniaczy. Stres oksydacyjny.
Zadaniem przeciwutleniaczy jest ochrona organizmu przed stresem oksydacyjnym.
Stres oksydacyjny to stan w którym dochodzi do zaburzenia równowagi pomiędzy wytwarzaniem a usuwaniem wolnych rodników. Przedłużających się stres oksydacyjny przyspiesza proces starzenia oraz jest przyczyną wielu chorób.
Redukcja tlenu, wolne rodniki, powstanie wolnych rodników
Tlen, którym oddychamy, ulega w organizmie czteroetapowej redukcji, w wyniku której
powstaje cząsteczka wody.
O2 + 4H+ + 4e- à 2H2O + energia i ADP + fosforan + energia à ATP + H2O
Kompleksy łańcucha oddechowego przeprowadzają reakcje "dwuelektronowo", przenosząc parzystą ilość wodorów lub elektronów na tlen, który jest substratem dla kompleksu IV. Jednakże niewielki procent przenoszonych przez kompleksy elektronów (około 2-5%) może opuścić łańcuch oddechowy (głównie na poziomie CoQ) i wejść w jednoelektronowe reakcje nieenzymatyczne z tlenem.
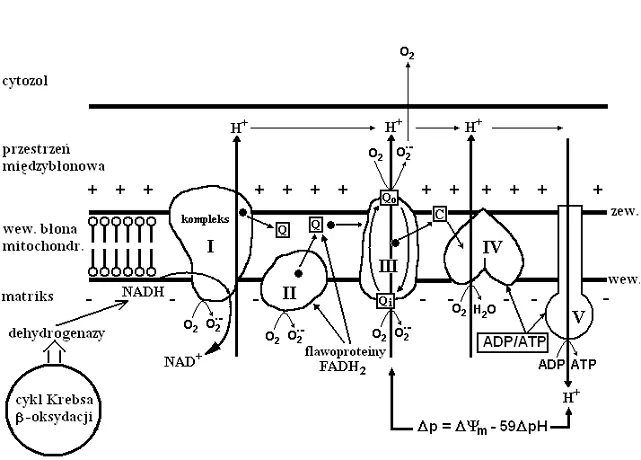
Produkty niecałkowitej redukcji cząsteczki tlenu nazwano reaktywnymi formami tlenu, (RFT) Mogą być to neutralne cząsteczki lub jony oraz wolne rodniki tlenowe.
Reaktywne formy tlenu (RFT) Wolne rodniki (WRT)
• anionorodnik ponadtlenkowy O2*-
• rodnik hydroksylowy OH•
• rodnik wodoronadtlenkowy HO2•
• rodnik nadtlenkowy ROO•
• rodnik alkoksylowy RO•
inne RFT
• nadtlenek wodoru H2O2
• kwas chlorowy (I) HOCl
• kwas bromowy (I) HOBr
Źródła reaktywnych form tlenu w organizmie
Organizmy żywe wytwarzają RFT w wielu podstawowych procesach biochemicznych, takich jak łańcuch oddechowy, metabolizm nukleotydów purynowych, mikrosomalny cykl hydroksylacyjny (cytochrom P-450), reakcje zachodzące z udziałem oksydoreduktaz. Produktem tych reakcji jest najczęściej anionorodnik ponadtlenkowy lub nadtlenek wodoru. Powstające RFT są produktami pośrednimi, które powinny ulec dalszej redukcji w kolejnych etapach reakcji biochemicznych, jednak z różnych przyczyn nie zawsze tak się dzieje.
Metaboliczne działania reaktywnych form tlenu.
W warunkach homeostazy RFT pełnią funkcje mediatorów i regulatorów metabolizmu – indukują różnicowanie komórek, aktywują wiele genów, m.in. onkogen c-fos, indukują apoptozę, wpływając na syntezę, uwalnianie lub inaktywację śródbłonkowego czynnika rozszerzającego naczynia (EDRF), działają rozszerzająco bądź kurcząco na ścianę naczyń krwionośnych, zwiększają przepuszczalność ścian naczyń włosowatych, stymulują transport glukozy do komórek, serotoniny do płytek krwi. Wpływają na przekazywanie sygnałów do komórek i wewnątrz komórek, regulują ekspresję genów. Mogą stawać się wtórnymi przekaźnikami zarówno w procesie wzrostu, jak i śmierci komórki. Aktywują białka kierujące podziałami komórkowymi (mitogenic activated protein). Biorą udział w procesach obronnych organizmu. Nadtlenki regulują ponadto syntezę prostanoidów.
Toksyczne działanie reaktywnych form tlenu – stres oksydacyjny
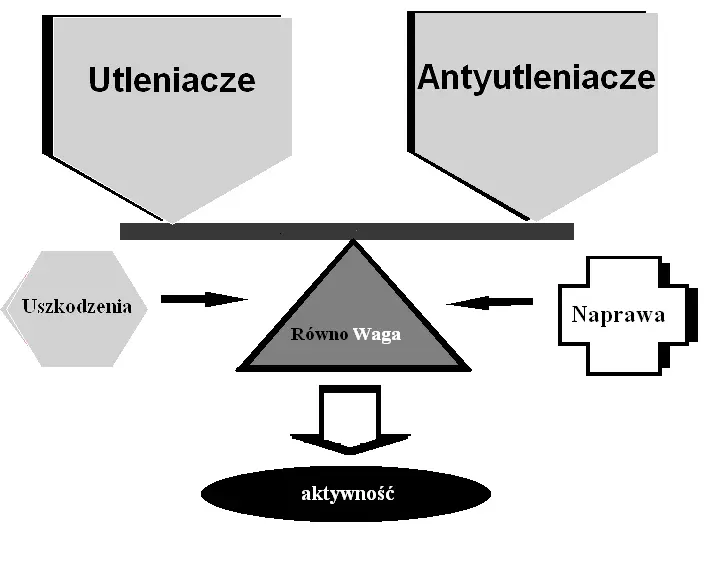
Nadmierna produkcja RFT oraz wyczerpanie przez organizm rezerw antyoksydacyjnych jest zjawiskiem nazywanym „stresem oksydacyjnym”. Stres oksydacyjny prowadzi do utleniania białek, co powoduje modyfikację ich struktury i zaburzenie funkcji. Następuje też utlenianie lipidów, uszkodzenia kwasów nukleinowych, depolimeryzacja kwasu hialuronowego i gromadzenie IgG. Reaktywne formy tlenu inaktywują ponadto inhibitory proteaz, co nasila działanie proteolityczne tych enzymów na tkanki. Wysokie stężenia RFT wyzwalają reakcje łańcuchowe, nasilające procesy uszkadzania biocząsteczek. Utlenianiu ulegają reszty wielonienasyconych kwasów tłuszczowych wchodzące w skład fosfolipidów, które są głównym składnikiem budulcowym błon komórkowych.
Mechanizm reakcji wolnorodnikowych

Produkty takiej nieenzymatycznej peroksydacji lipidów zmieniają właściwości fizyczne błon komórkowych, co może prowadzić do ich uszkodzenia. Na poziomie molekularnym RFT powodują degradację kolagenu, zaburzenia syntezy i inaktywację proteoglikanów, inaktywację enzymów, pęknięcia nici DNA, uszkodzenie chromosomów, powstawanie mutacji prowadzących do zmian nowotworowych, inhibicję fosforylacji oksydacyjnej w mitochondriach, zaburzenia struktury cytoszkieletu (polimeryzację aktyny, rozerwanie mikrofilamentów), modyfikację właściwości antygenowych komórek oraz zaburzenie wewnątrzkomórkowej homeostazy wapnia.
Mechanizmy obronne komórek przed reaktywnymi formami tlenu
W komórkach istnieje wiele skutecznych mechanizmów chroniących przed toksycznym działaniem RFT. W warunkach homeostazy, dzięki działaniu enzymatycznych i nieenzymatycznych antyoksydantów, nadmiar RFT jest likwidowany i uszkodzenia biomolekuł są naprawiane. W miejscu lokalnego pojawienia się nadmiaru RFT są uruchamiane mechanizmy obronne. To, który antyoksydant zostanie użyty w reakcji z rodnikiem lub inną reaktywną formą tlenu, zależy od jej właściwości i miejsca powstania oraz od tego, jakie struktury mogą potencjalnie stać się jej celem. Kwas askorbinowy jest najskuteczniejszym antyoksydantem rodników rozpuszczalnych w wodzie. Kwas moczowy najlepiej neutralizuje działanie dwutlenku azotu. W walce z żelazozależną peroksydacją lipidów najbardziej skutecznymi antyoksydantami są transferyna i ceruloplazmina. Warto zauważyć, że w odpowiedzi na stres oksydacyjny bierze udział nie pojedynczy antyoksydant, lecz cała grupa antyoksydantów, ponieważ ten sam rodnik (RFT) może uszkadzać różne struktury docelowe. Dobrym przykładem jest kwas askorbinowy, który przeciwdziała peroksydacji lipidów wywołanej przez RFT z dymu tytoniowego, ale nie ma wpływu na oksydacyjne uszkodzenia białek osocza.

